掘金创新药| 复宏汉霖PD-L1/TIGIT双抗注射液申报临床:系国内第三款 谁能拔得头筹?
《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
根据药渡数据,2022年1月3日至2022年1月9日,国家药品监督管理局药品审评中心(CDE)共收到9家上市公司(含上市公司控股公司)提交的10个化学新药、治疗用生物制品新药申请。
一周新药申请
本周上市公司方面,恒瑞医药(600276,SH)共申报2个临床申请,康龙化成(300759,SZ)、百济神州(06160,HK)、再鼎医药(09688,HK)、复宏汉霖(02696,HK)、德琪医药(06996,HK)、长春高新(000661,SZ)、通化东宝(600867,SH)、微芯生物(688321,SZ)各申报1个临床申请。
一周热评
1.复宏汉霖PD-L1/TIGIT双抗注射液申报临床,系国内第三款
1月6日,CDE官网显示,复宏汉霖的PD-L1/TIGIT双抗注射液HLX301临床申请获得受理,这也是公司第二款申报临床的双抗药物。2021年11月,公司靶向4-1BB/EGFR的双抗药物HLX35临床申请获受理。
HLX301为公司自主开发的创新型抗PD-L1和抗TIGIT双特异性抗体,拟用于多种晚期实体瘤治疗。复宏汉霖此前发布公告称,HLX301的TIGIT结合域来源于公司人源化羊驼重链可变区单域抗体(VHH)噬菌体展示库筛选出的对TIGIT具有高亲和力、高特异性的VHH片段;临床前研究结果表明,HLX301可与人PD-L1和TIGIT特异性结合并阻断PD-1/PD-L1和TIGIT/PVR结合而切断PD-1和TIGIT下游负向信号,可抑制肿瘤的生长,且耐受性、安全性良好。2021年11月,HLX301在澳大利亚获批临床。
行业洞察:
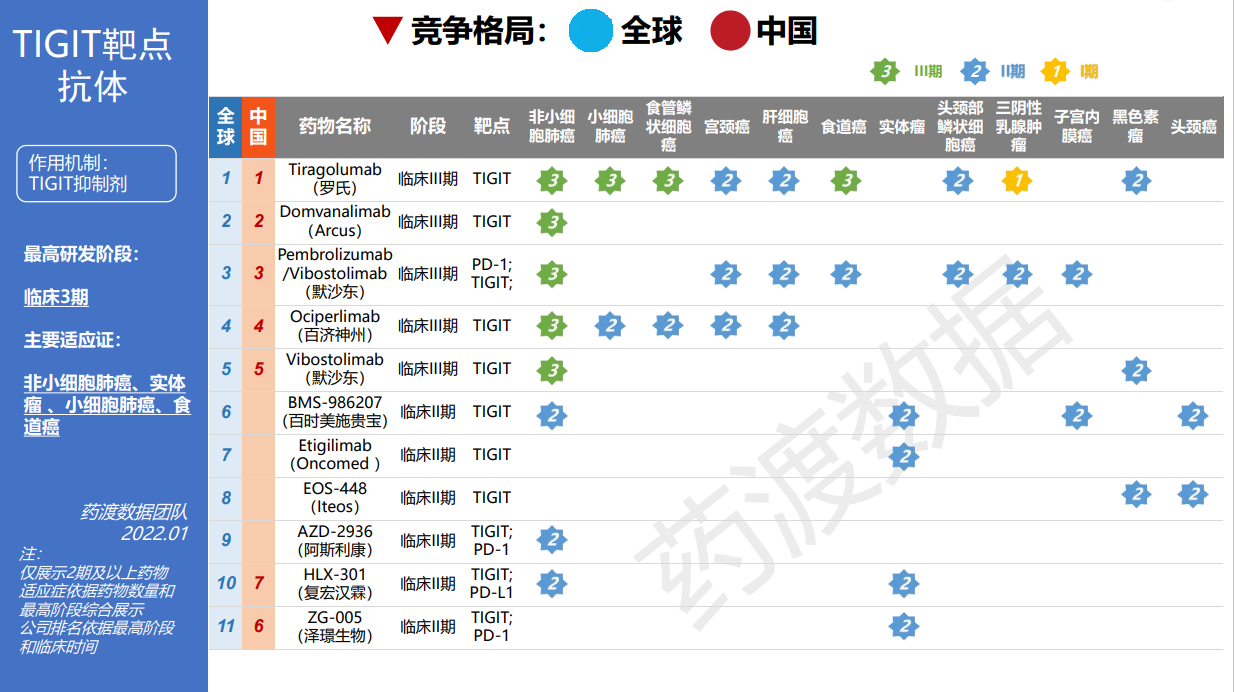
据了解,复宏汉霖的HLX301是国内第三款申报临床的PD-L1/TIGIT双抗药物。2021年11月26日,CDE官网显示,普米斯生物技术(珠海)有限公司的PM1022注射液临床申请获得受理,成为国内首款申报临床的PD-L1/TIGIT双抗。紧接着,南京圣和药业股份有限公司的PD-L1/TIGIT双抗药物SH006注射液也于2021年12月申报临床。短短两个月时间内,三款药物相继申报临床,PD-L1/TIGIT双抗研发竞争加剧。
公开资料显示,TIGIT阻断剂具有治疗多种晚期肿瘤的前景,包括非小细胞肺癌、胃癌、黑色素瘤、多发性骨髓瘤,是PD-1、PD-L1、CD47等热门靶点之外的另一大热门靶点。从全球范围来看,目前尚无抗TIGIT类药物上市,但国内外多家企业在研的TIGIT单抗/双抗药物已进入到临床试验阶段。
药渡数据显示,目前国内药企已有6款TIGIT单抗申报临床,分别是信达生物的IBI939,百济神州的BGB-A1217,君实生物的JS006,百奥泰的BAT6021和BAT6005,华海药业的HB0030。除了百济神州的BGB-A1217处于三期临床,其余药物均处于一期临床。此外,国内还有两款PD-1/TIGIT双抗药物申报临床,分别是信达生物的IBI321和泽璟制药的ZG005。
图片来源:药渡数据库
公司点评:
复宏汉霖以生物类似药起家,目前已成功上市四款生物类似药,包括首个国产生物类似药利妥昔单抗、首个中欧双批的国产单抗生物类似药曲妥珠单抗、阿达木单抗以及贝伐珠单抗。2018年到2020年,复宏汉霖三年累计亏损超23亿元。2020年,公司商业化取得突破性进展,利妥昔单抗、曲妥珠单抗、阿达木单抗商业化落地后推动销售额迅速增加。2021年上半年,公司实现营收6.34亿元,同比增长约474%。
随着复宏汉霖多款具备竞争优势的生物类似药陆续进入商业化放量阶段,公司业绩有望持续增长,加码创新药成为公司的战略重点。公司的重磅PD-1产品斯鲁利单抗的上市申请已被CDE纳入优先审评,有望于2022年正式上市。截至2021年12月,公司尚有多个处于不同临床阶段的创新药产品。
图片来源:公司官网
《掘金创新药》研究员认为,继PD-1、PD-L1、CD47等成为热门靶点后,TIGIT会是近年来另一大热门靶点,目前全球范围内尚无TIGIT类药物获批上市,市场潜力巨大;从申报临床的时间上来看,复宏汉霖的HLX301并不算晚,处于国内PD-L1/TIGIT双抗药物研发的第一梯队,但谁能拔得头筹仍未可知。由于该药物临床申请刚获受理,未来试验结果存在众多不确定性,未来若能顺利完成临床试验并上市,将有望支撑公司业绩持续增长。
2.微芯生物西奥罗尼胶囊拟治疗软组织肉瘤申报II期临床,正推进多个适应症临床试验
1月5日,微芯生物发布公告称,公司的西奥罗尼胶囊II期临床试验申请获得受理,适应症为治疗标准治疗失败的晚期或不可手术切除的软组织肉瘤患者。西奥罗尼是公司自主设计和研发的具有全球专利保护的新化学结构体,属于多靶点多通路选择性激酶抑制剂。
西奥罗尼属于小分子抗肿瘤原创新药,可选择性抑制Aurora B、CSF1R和VEGFR/PDGFR/c-Kit等多个激酶靶点。公司称,西奥罗尼通过抑制肿瘤细胞有丝分裂、抑制肿瘤血管生成和调节肿瘤免疫微环境的三种活性机制,实现多通路机制的抗肿瘤药效,从而发挥综合抗肿瘤作用,具有相对同类机制药物更优异的动物药效活性和良好的安全性。公司还称,临床前研究提示,西奥罗尼作为多靶点多通路选择性激酶抑制剂针对软组织肉瘤具有潜在的治疗价值。
行业洞察:
据了解,软组织肉瘤(STS)是来源于非上皮性骨外组织的一种恶性肿瘤,可发生于任何年龄段和全身各部位,约占所有恶性肿瘤的1%,是一类罕见肿瘤。目前,手术和放疗等局部治疗方法在软组织肉瘤中取得了一定的成功,但多数存在复发和转移风险,临床上可供选择的系统治疗方案主要是化疗药物,对于晚期STS患者,全身治疗的作用有限,临床响应率不超过50%,临床对新的治疗药物仍存在迫切需求。
2019年7月,正大天晴宣布取得盐酸安罗替尼胶囊用于治疗软组织肉瘤的药品注册批件,安罗替尼成为国内首个获批的软组织肉瘤靶向药。此前,安罗替尼曾于2017年6月被FDA授予治疗软组织肉瘤的孤儿药资格认定。2020年9月,君实生物特瑞普利单抗治疗软组织肉瘤获FDA孤儿药资格认定。
除了软组织肉瘤,西奥罗尼还同时开展了多个肿瘤适应症的临床试验。目前,西奥罗尼正在开展单药治疗小细胞肺癌和联合紫杉醇治疗卵巢癌的三期临床试验以及治疗肝癌、淋巴瘤、其他神经内分泌肿瘤等多个适应症的不同阶段研究。西奥罗尼针对小细胞肺癌和卵巢癌的临床研究已被CDE纳入“突破性治疗品种”。此外,西奥罗尼治疗小细胞肺癌的Ib/II期临床试验正在美国推进中,并已于2021年9月被FDA授予孤儿药资格认定。
公司点评:
微芯生物是科创板“创新药企业第一股”,2019年8月,微芯生物成功登陆科创板。成立二十余年来,微芯生物目前有两个国家1类原创新药获批上市。公司的西达本胺是中国首个获批治疗外周T细胞淋巴瘤的药物,乳腺癌适应症的获批使西达本胺的适应范围由血液肿瘤拓展到了实体瘤。西达本胺也是公司主要的商业化产品,2020年实现销售收入2.45亿元,对公司营收贡献超90%。
2021年前三季度,微芯生物实现营收2.77亿元,同比增长48.61%,归母净利润为-2425万元,同比下降163.12%,公司称主要系研发费用和销售费用大幅增加所致。2019年和2020年,公司研发投入占营收比例分别为45.02%和50.94%。2021年10月,微芯生物以2型糖尿病为适应症的西格列他钠获批上市,糖尿病领域市场空间广阔,公司业绩有望获得持续增长。
《掘金创新药》研究员认为,作为微芯生物继西达本胺和西格列他钠的又一大重磅新药,目前西奥罗尼正同时推进多个适应症临床试验,其中治疗小细胞肺癌和卵巢癌的适应症有望率先获批上市;若西奥罗尼治疗软组织肉瘤的临床试验进展顺利,或将进一步扩大西奥罗尼的市场想象空间,提升公司业绩弹性。
每日经济新闻
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”