3项临床数据亮相国际学术舞台,亘喜生物如何“妙手”频出?
每年5–6月都是全球医药学术年会召开的高峰期,其中,ASCO、EHA年会作为肿瘤界极具影响力的两大盛会,是全球肿瘤药物研究和临床治疗领域专家学者颇为关注的学术舞台。近些年,随着国内创新医药产业进程加速推进,越来越多来自中国的制药企业及专家学者也都相继登台亮相。以ASCO 2022年会为例,共有50余项由中国学者参与的研究被收录,13位教授受邀进行口头报告,涉及多个肿瘤领域、涵盖各类药物形态。其中,这两年国内话题度很高的CAR-T细胞疗法也引起了大家的注意,包括亘喜生物、原启生物、科济生物等多家CGT企业也都公布了各自最新的临床数据。
值得一提的是,致力于引领下一代CAR-T细胞疗法的亘喜生物一口气打出“三连击”,先是在ASCO 2022年会上公布GC012F治疗复发难治性多发性骨髓瘤(RRMM)的长期随访数据,紧接着又在EHA2022年会上展示该研究的更新数据(由上海长征医院杜鹃教授做口头报告)及同款药物治疗B细胞非霍奇金淋巴瘤(B-NHL)的首次人体试验数据,同时还公布了另一款同种异体产品GC502治疗复发/难治性急性B淋巴细胞白血病(r/r B-ALL)的最新临床数据。6月13日,亘喜生物还就以上临床数据召开投资者会议,进行详细解读。
GC012F治疗RRMM长期随访数据入选ASCO 2022及EHA2022年会口头报告(来源:ASCO/EHA官网)
从整个行业来看,自2017年CAR-T疗法首次获FDA批准以来,全球已有8款CAR-T药物陆续上市,市场规模也在逐步扩容;2021年,最先获批上市的两款CAR-T产品Kymriah和Yescarta年销售额均已超过5亿美元。不过,虽然针对血液肿瘤疗效斐然,但传统CAR-T疗法因需个性化制备而带来了价格高、生产时间过长、缺乏高质量的自体T细胞等问题,限制了可及性。
来源:医药魔方NextPharma
当然,作为CGT法领域最为成熟的一项疗法,CAR-T依然是一条热门赛道。据医药魔方Nextpharma数据库显示,全球有近800个项目同步在研,六成以上项目由中国公司推动,且已有多家公司取得了全球领先的突破成果。如何通过创新演进让CAR-T疗法带来更大的临床获益,业界抱有期待,比如:探索新治疗靶点、开发双靶点CAR-T、通用型CAR-T、攻克实体瘤治疗等。为了实现这些目标,扩大CAR-T疗法的市场空间,全球玩家可谓“八仙过海,各显神通”。而凭借自主研发的FasTCAR及TruUCAR两大开创性平台,亘喜生物显然想在这场全球对弈中,进一步挑战行业“本手”态势,下出自己的“妙手”棋局。
全球(上)和中国(下)在研CAR-T项目概况(来源:医药魔方NextPharma)
快速自体CAR-T 通用型CAR-T齐步走,核心产品矩阵展现卓越临床潜力
双靶点CAR-T,双适应症探索
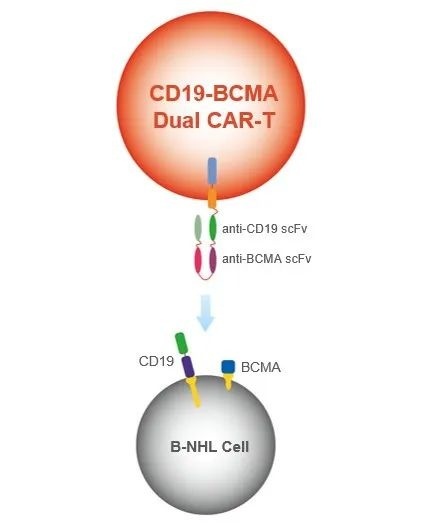
作为基于FasTCAR平台,并结合Dual CAR技术打造的核心产品,GC012F是一款被寄予厚望的差异化BCMA/CD19双靶点CAR-T自体疗法,旨在为传统CAR-T疗法现存的重大挑战提供解决方案,既能缩短患者等待治疗的时间,又能提供表型更年轻、健康状态更好且扩增能力更强的CAR-T细胞。
GC012F治疗MM(来源:亘喜生物)
具体来说,FasTCAR平台主打“次日完成生产”优势,能通过大幅提高制备效率,从而显著降低生产成本,并改善产品细胞的年轻态和健康度。据悉,该工艺在理想状态下,有望能将“采血-回输”的周期缩短至11天,除了直接减轻患者的经济负担,更能有效降低晚期患者的医学风险,包括免去一些可能影响最终疗效的桥接治疗。此外,Dual CAR设计的加成,能潜在降低因抗原逃逸而导致疾病复发的概率,从而进一步增强疗效。
来源:亘喜生物官网
亘喜生物于2020年正式启动GC012F治疗RRMM的由研究者发起的临床试验(IIT),截至目前是全球首款针对RRMM适应症开展临床研究的双靶点CAR-T疗法。在长期随访中,GC012F展现出极具竞争力的安全性和有效性数据,因此也在2021年11月被美国FDA授予孤儿药资格认定。此次亘喜生物先后在ASCO和EHA年会上更新了两组GC012F的数据。
截至6月8日(进行了超2.5年随访)的最新临床数据显示:全部29例患者的中位随访时间为11个月(范围:4.9–34.5),中位既往治疗线数达5次 (范围: 2–9)。其中90%(26/29)的患者根据mSMART 3.0标准被定义为高危患者,且都已接受过蛋白酶抑制剂、免疫调节抑制剂以及抗CD38单抗等多重既往治疗。
疗效方面,全体患者(29/29)100%达到MRD阴性;75.9%(22/29)达到微小残留病灶阴性-严格意义上的完全缓解(MRD- sCR),中位缓解持续时间 (DoR)已达15.7个月。值得注意的是,ASCO年会公布的DL3组的总缓解率(ORR)为93.8%(15/16),而到了EHA年会这一数字变为100%(17/17),可以推断GC012F有望带来不断加深且持久的疗效响应,尤其还要考虑到该临床试验中绝大多数患者为难治的高危患者。
另外值得关注的是,GC012F的安全性在目前治疗RRMM的CAR-T疗法中具有显著优势。此次公布的随访结果与早先观察到的结果一致,主要出现的是低级别的细胞因子释放综合征(CRS)(0–2级:93%,3级:7%),未出现4级或5级CRS;且未观察到任何级别的免疫效应细胞相关神经毒性(ICANS)。
从管线信息中可以看到,亘喜生物还在同步开展针对MM初治患者的临床研究,而安全性对于早线治疗患者的意义更为深远。
来源:医药魔方NextPharma
总的来说,相比于已上市和正在申请上市的同类产品相同适应症数据(上表),基于当前样本量,GC012F治疗RRMM在疗效和安全性上都分别展现出潜在的显著优势,更大规模的临床试验结果令人期待。据悉,亘喜生物预计会在2022年下半年,将分别向美国FDA和中国CDE递交GC012F治疗RRMM适应症的临床试验申请(IND),以进一步通过更深入的临床研究获得更充分的验证。
除了RRMM这一适应症,鉴于B-NHL细胞上除了有CD19的高表达外,39%~97%的临床样本也会表达BCMA,亘喜生物因此开启了GC012F治疗B-NHL的探索,目前正在国内开展一项评估GC012F治疗B-NHL的安全性及耐受性的早期探索性IIT。由此,GC012F又成为首款针对B-NHL适应症开展相关人体试验的BCMA/CD19双靶点CAR-T细胞疗法。在EHA2022年会上,亘喜生物对外披露了其首次人体试验(FIH)数据。
GC012F治疗B-NHL(来源:亘喜生物)
从资料来看,该研究招募了3例患者接受了GC012F的单次输注治疗。患者中位既往治疗线数达2次,且均呈现高肿瘤负荷特点。截至2022年2月22日,所有3例患者在输注治疗后快速获得缓解,第28天时100%达到完全缓解(CR)。在3个月的随访中,2例可评估患者取得持续缓解。安全性方面,同样未观察到剂量限制性毒性及ICANS。2例患者出现了1级CRS,1名患者出现3级CRS(持续2天),未出现4级或5级事件。
结合以上两项临床数据可以看出,GC012F是首款针对RRMM、B-NHL都已展现出优异初步疗效的双靶点CAR-T候选产品,具有广阔临床应用前景。此外,同时靶向CD19和BCMA靶点的设计策略,还有望通过减少抗原逃逸,提高质量响应率,降低复发率(尤其对于RRMM患者,靶向BCMA可以杀伤恶性浆细胞,靶向CD19则可杀伤MM细胞及其祖细胞)。
巧妙设计的通用型CAR-T
除了自体疗法,亘喜生物的通用型细胞疗法候选产品GC502治疗r/r B-ALL的临床数据也继AACR公布FIH研究结果后,在EHA2022年会上更新了临床数据,安全性方面得到进一步验证。
GC502是基于亘喜生物专有的TruUCAR平台开发的CD19/CD7双靶向通用型同种异体CAR-T。目前,该候选产品正在国内开展一项针对B细胞恶性血液肿瘤的开放性、非随机IIT研究,并入组给药了4例r/r B-ALL患者(两个DL)。所有患者均为深度经治患者,接受过包括自体或供者来源的靶向CD19或靶向CD19/CD22的CAR-T细胞治疗。
疗效方面,4例可评估患者中有3例达到了微小残留病灶阴性的完全缓解/血细胞数量未完全恢复的完全缓解(MRD-CR/CRi);1例患者在1个月时达到了部分缓解(PR),随后接受了造血干细胞移植。
安全性结果相较于AACR年会时,又新增了一例可评估患者数据,最新数据为配方B组2例患者出现1–2级CRS,配方A组2例患者为3级CRS,未出现4级/5级的CRS,同时未观察到ICANS或急性移植物抗宿主病(aGvHD)。
兼顾产品的安全性和有效性是亘喜生物开发通用型CAR-T产品的出发点。相较于自体CAR-T疗法,通用型CAR-T的挑战在于解决宿主与药物间相互的排异反应。对于移植物抗宿主病(GvHD),亘喜选择使用基因编辑技术敲除T细胞中的内源性T细胞受体(TCR),防止CAR-T攻击宿主。
而对于宿主抗移植物排异反应(HvG),亘喜则巧妙利用双靶向CAR结构以预防HvG。在传统清淋治疗后,不再依赖与额外免疫抑制剂联用,从而优化了该疗法的安全性、有效性,并拓展适用性。具体而言,靶向CD7的CAR结构可以抑制患者的T细胞和NK细胞对于异体CAR-T细胞的排异,而靶向肿瘤抗原(如GC502靶向CD19)的CAR结构则能特异性杀伤癌细胞,针对不同肿瘤适应症还能替换结构。除此之外,亘喜生物还在TruUCAR的基础结构中嵌入了一个增强型分子,以提升TruUCAR-T细胞的扩增能力。
来源:亘喜生物官网
从目前获得的数据来看,GC502是通过TruUCAR平台开发通用型CAR-T疗法的一次有力例证,有望为那些不适合接受自体CAR-T细胞疗法的r/r B-ALL患者提供深度缓解的疗效,也大大提升了CAR-T疗法可及性。
CAR-T治疗癌症空间犹存,创新是脱颖而出的关键
从各种意义上来说,CAR-T治疗癌症领域的发展空间广阔,然而同质化竞争也很严重。如下图所示,目前全球以CD19为靶点的CAR-T临床试验项目占比最高,其次是BCMA。在激烈的同质化竞争中,创新和差异化策略是企业保持生命力、脱颖而出的关键。
全球CAR-T疗法靶点TOP10(来源:医药魔方NextPharma)
当然,全球CAR-T疗法的棋盘还远未到无处落子的局面,总有棋高一招的玩家,通过自身的洞察眼观与创新实力,下出更多招“妙手”,循序渐进式破局。
举例来说,1)CAR-T治疗正在往前线治疗不断挺进,这也意味着更大的市场空间。今年3月,美国MD安德森癌症中心领衔多家癌症研究机构同Kite制药合作,在Nature Medicine发表论文表明,CAR-T疗法axicabtagene ciloleucel(Axi-cel)作为一线疗法治疗大B细胞淋巴瘤(LBCL)患者,客观缓解率达到了89%,有78%的患者实现了完全缓解。且据推测,治疗12个月时的预估持久缓解率、无进展生存率可分别达到81%和73%。作者表示,通过进一步的研究,CAR-T疗法很有可能可以转变成高危型淋巴瘤患者的一线疗法。前文也提到亘喜生物的GC012F也已启动了治疗MM初治患者的临床研究。
来源:Nature Medicine
2)通用型CAR-T进展积极,带来更大降价空间:不久前(5月12日),基因编辑生物技术公司 Caribou Biosciences宣布了其同种异体抗CD19 CAR-T细胞疗法在治疗r/r B-NHL患者的ANTLER研究I期积极初步结果。队列1(5例患者可评估)的总缓解率(ORR)达100%,完全缓解率(CR)达80%。在国内以亘喜生物、北恒生物为代表的企业也开发出了有前景的通用型疗法。
3)针对实体瘤的CAR-T技术不断发展,带来了更广阔的适应症空间:继成功治疗血液恶性肿瘤后,实体瘤已然成为CAR-T疗法亟待攻占的“下一城”。近几年,越来越多克服实体瘤阻碍的CAR-T技术被开发出来,如各种奇思妙想的CAR-T“开关”。亘喜生物也拿出了SMART-CART增强型技术模块,通过阻断内源性TME分子信号传导,并将TME抑制信号转化为T细胞激活信号,进而促进CAR-T细胞在肿瘤组织中的扩增、持久性以及肿瘤杀伤能力,并在临床前研究中已经初现优势。
成立5年以来,在依托自主创新,力争革新CAR-T细胞疗法的道路上,亘喜生物脚踏实地、稳中求进。科研团队在深刻理解细胞免疫学特性的基础上,结合差异化的基因编辑及工艺开发能力,通过IIT研究不断筛选潜在同类最优产品,进而更好地把握研发成功率。
如果将传统CAR-T技术比作“本手”,亘喜生物在这盘棋局上可谓 “妙手”频出。本手、妙手,可相生相长,如能由本入妙,避俗而行,必能在火热的CAR-T赛道上脱颖而出。我们也期待亘喜生物未来更多亮眼的表现,能让患者更好地受益于这些高效疗法。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”
为您推荐
算法反馈精品有声
热门文章
精彩视频

凤凰财经官方微信